
Allgemeine Hinweise zu und zur Arbeit mit
Mikroorganismen:
Mikroorganismen sind Lebewesen, die nicht mit bloßem Auge erkannt werden können. Das sind Bakterien, Protozoen (Urtierchen), Pilze, Mikroalgen und Viren. Die Wissenschaft, die sich mit ihnen befasst, ist die Mikrobiologie (, die aber weiter untergliedert ist. Etwa in die Bakteriologie, die Virologie, die Mykologie (Pilze) und die Protozoologie (Urtierchen).
Da manche Mikroorganismen Krankheitserreger sind, ist bei der Arbeit mit ihnen auf besondere Vorsicht zu achten. Dazu zählt Händewaschen vorher und nachher, freiräumen (Alkohol oder Isopropanol) und desinfizieren des Arbeitsplatzes, das Vermeiden von Luftzug, direkter Sonneneinstrahlung. Natürlich darf am Arbeitsplatz auch nicht gegessen oder getrunken werden, die Kulturen dürfen auch nicht offen stehengelassen oder berührt werden, die verwendeten Gefäße und Geräte müssen sorgfältig sterilisiert werden (Auskochen, abflammen, …).
Der Nachweis bzw. die wissenschaftliche Beschäftigung mit Mikroorganismen kennt verschiedene Methoden. Um Mikroorganismen in einer großen Flüssigkeitsmenge nachzuweisen verwendet man die Membranfiltermethode. Dabei wird die Flüssigkeit durch einen feinporigen Membranfilter gesogen, auf dessen Oberfläche sich die Mikroorganismen abscheiden und anschließend auf einem geeigneten Nährboden gelegt und „bebrütet“ werden können. Auf festen Nährböden können beispielsweise Koloniezahlen bestimmt werden (Mit dem Mikroskop).
Die Bestimmung von Mikroorganismen kann mikroskopisch (Größe, Form, Beweglichkeit, …) oder biochemisch oder auch auf andere Arten erfolgen.
Es gibt verschiedene Nährmedien, auf denen
Mikroorganismen gezüchtet werden können:
Sie können unterschiedlich feucht sein und müssen einen geeigneten PH-Wert besitzen.
Es gibt feste und flüssige (Nährboullion), natürliche oder selektive (nur für bestimmte Arten/Gruppen) Nährmedien.
Feste Nährmedien werden Nährböden genannt. Verwendung findet etwa Ager-Ager in Petrischalen oder Reagenzgläsern (Schrägagerröhrchen – schiefe Haltung – hat größere Oberfläche). Nährkartonscheiben (NKS) sind Nährböden in Trockenform, sie müssen mit Wasser versehen werden. Es gibt versch. NKS:
+ Standard NKS hat einen ph-Wert von 7.2 und ist ein sog. allgemeines Nährmedium
+WürzNKS (mit Bierwürze!) hat einen ph von 5.7, damit können Hefe- und Schimmelpilze nachgewiesen werden.
+EndoNKS ist selektiv für den Nachweis von Escherichia coli

Geräte: Filtrationsvorsatz, Bunsenbrenner, Sezierbesteck, Klebestreife, Stifte Verbrauchsmaterial: Sterile Spritze 20ml, Membranfilter (Porengröße 2 μm), 10 Petrischalen (5×Standard NKS, 5×Würz-NKS), Klebestreifen, H2O
1a) Sterilisiertes (keimfreies) Wasser herstellen: Deionat in Becherglas → mit abgeflammter Pinzettenspitze Membranfilter aus seinem Behältnis entnommen → in aufgeschraubten abgekochten Filtrationsvorsatz legen → auf sterile Spitze schrauben. Deionat in die Spritze aufziehen, dadurch erhält man keimfreies Wasser für die Untersuchung (Mikroorganismen bleiben an Membran zurück).
1b) Vorbereitung der NKS: Mit dem gesäubertem Wasser in der Spritze (Filtrationsvorsatz abnehmen) die insgesamt 10 mit abgeflammter Pinzette in die abgekochten Petrischalen gelegten NKS gut durchtränken, diese sofort geschlossen. Es sollte jeweils klar erkennbar sein, welche Art von NKS in einer einzelnen Petrischale liegt. Die Petrischalen werden mit Namen, Ort und Datum, evtl. Prüfzeit) beschriftet.
1c) Platzierung der NKS: Die Petrischalen werden (jeweils in 2er-Gruppen: Standard+WürzNKS) an die für sie schon vorher überlegten Orte ausgebracht, geöffnet und für 15 bis 60 Minuten stehengelassen und dann wieder verschlossen (mit Klebestreifen) und eingesammelt.
1d) Bebrütung an einer lichtgeschützten Stelle bei Raumtemperatur mindestens 48h lang, alternativ im Brutschrank.
1e) Auswertung: Nach einigen Tagen ohne(!) die Schalen zu öffnen, daher makroskopisch (bzw. unter dem Stereomikroskop) nach Größe, Farbe und Wuchsform. Bei einer längeren Entwicklungszeit müssen die NKS aber immer wieder angefeuchtet werden.
|
Aufstellungsort |
Mikroorg.
Standard-NKS |
Mikroorg. Würz-NKS |
|
1) Buben-Klo links unter Schüssel |
Es konnte bei einer Entwicklungszeit von einer Woche in allen Proben zumindest ein bisschen mikrobiologische Aktivität nachgewiesen werden. |
|
|
2) Fensterbrett BU-Saal |
||
|
3) Fensterbrett Buffet |
||
|
4) Fingerabdruck |
||
|
5) Nicht geöffnet - Placebo |
||
|
Aufstellungsort |
Mikroorg.
Standard-NKS |
Mikroorg. Würz-NKS |
|
1) ♂Klo unter Schüssel |
Milchig-weiße Farbe, plasma-/gelertartig, unregelmäßige konvexe Form |
Weiße, vulkanförmig angeordnete Schimmelpilzsporen und grüner, undurchsichtiger Schimmelpilz mit unregelmäßiger Form und konvexen Polstern |
|
2) ♀Klo unter Schüssel |
Runde, konvexe Form. Durchsichtig grau. Feinster Flaum? Schimmmelpilz?? |
Runde, konvexe, flaumige weiße Polster, dazwischen unregeläßige, grüne, flächig-flaumige Flecken → Schimmelpilze. |
|
3) Fensterbrett Buffet |
Runde konvexe Büschel von undurchsichtiger grauer (gräulicher :-) Farbe; außerdem runde nicht büschelhafte Flecken von ähnlichen Eigenschaften. |
Rhizoide oder runde, weiß-undurchsichtige Polster und Flecken; Unregelmäßige grüne Flaumpackete (div. hellrün-dunkelgrün). |
|
4) Fingerabdruck |
Feinste gräuliche Haut auf NKS, wirkt schleimig und ekelerregend. |
Wahre Prachtlandschaft: Dunkelgrüne, knopfförmige dick-konvexe Polster mit deutlich erkennbaren Sporenkapseln; Kurze weiß-gelbliche Flaumbüschel mit unregelmäßige Grundform; Undurchsichtige und durchsichtige graue Flecken; ein einzelner roter(!) Punkt, leicht gezackter Rand. |
|
5) Nicht geöffnet - Placebo |
Ähnlich Nro. 4 |
Einzelne durchsichtige, flaumig-weißliche Flecken. |
Auffallendstes Ergebnis war die anscheinende Reichhaltigkeit (meines!) Fingerabdrucks an Mikroorganismen (Schimmelpilzen). Ich möchte das jedoch entweder auf böswillige nachträgliche Kontamination (ohne hier jemand konkret verdächtigen zu können) bzw. auf die Tatsache, das ich meinen Finger mindestens eine Minute lang auf die NKS gedrückt habe, zurückführen.

Geräte: Filtrationsgerät und Zubehör → siehe auch kopierte Zettel mit bebilderter technischer Anleitung
Verbrauchsmaterial: 2 Petrischalen (+Würz/StandardNKS), Wasserprobe
Durchführung: Um Mikroorganismen aus einer flüssigen Probe herausfiltern zu können, wird ein Filtrationsgerät verwendet (Membranfiltermethode, siehe kopierte Zettel mit genauer Anleitung). In diesem wird mit einer Spritze ein Unterdruck erzeugt und dadurch das Probenwasser durch einen Membranfilter gesogen, an dem die Mikroorganismen hängen bleiben. Anschließend wird der Membranfilter (mit abgeflammter Pinzette hantieren!) entnommen und auf einen Nährboden gelegt.
Ergebnis: Zumindest bei der WürzNKS ein Gemisch aus verschiedensten farbigen Flecken, Kulturen und Pilzen – auf die genaue Beschreibung derselben wäre hier wenige ziel führend. Auf alle Fälle müssen im Teichwasser in der Tat eine große Menge an Mikroorganismen zu finden sein.

Geräte: Erlenmeyerkolben, Saugpipette, Objektträger, Deckgläser, Mikroskop
Verbrauchsmaterial: Backhefe (Saccharomyces cerevisiae), 10%ige Saccharoselösung → Hefesuspension in Saccharose (Ansatz 2h)
Durchführung:
-Erbsengroßes Stück Backhefe in 10ml Saccharoselösung suspendieren und direkt nach dem Ansatz parallel mit der seit 2h angesetzten Suspension untersuchen, außerdem auch nach 30min.
-Bei möglichst starker Vergrößerung mikroskopieren und die Anzahl der (sproßenden) Hefezellen pro Sehfeld ermitteln.
Auswertung:
-Aufgrund Zeitmangels nur in Ansätzen durchgeführt.
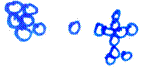 -Statistische
Darstellung des Zusammenhangs zwischen prozentualem Anteil von sproßenden Hefezellen/Sehfeld
und Kulturdauer (Werte: 0, 30, 120 min): Rein theoretisch sollte sich ein
exponentielles Wachstum nachweisen lassen.
-Statistische
Darstellung des Zusammenhangs zwischen prozentualem Anteil von sproßenden Hefezellen/Sehfeld
und Kulturdauer (Werte: 0, 30, 120 min): Rein theoretisch sollte sich ein
exponentielles Wachstum nachweisen lassen.
-Zeichnerische Darstellung versch. Sprossungsstadien (400-fache Vergrößerung – s. Abb.)